Bij de ziekte van Parkinson sterven bepaalde zenuwcellen in de hersenen. Patiënten kunnen alleen vertragen en hun spieren worden stijf. Armen en benen beginnen in vrede te trillen. Veel patiënten hebben ook problemen met denken en worden dement. Lees hier: Wat is Parkinson precies? Wie heeft er last van? Hoe drukt hij zichzelf uit? Welke behandelingsopties zijn er?

Parkinson: kort overzicht
- Typische symptomen: Langzame bewegingen, gebrek aan lichaamsbeweging, spierstijfheid, beven in rust, gebrek aan stabiliteit van de rechtopstaande houding, stijve gezichtsuitdrukkingen
- oorzaken:Ziekte van Parkinson: sterven aan dopamine-producerende cellen in de hersenen; secundair aan de ziekte van Parkinson: andere aandoeningen, medicijnen of intoxicaties; Genetisch Parkinson-syndroom: genetische veranderingen
- Belangrijke onderzoeken: Lichamelijk en neurologisch onderzoek, L-Dopa-test, computertomografie (CT), beeldvorming met magnetische resonantie (MRI)
- Behandeling opties: Medicijnen (zoals Levo-Dopa), fysiotherapie, logopedie, ergotherapie, diepe hersenstimulatie (THS)
Parkinson: symptomen
Stijve spieren, vertraagde bewegingen en trillende handen zijn typische kenmerken van de ziekte van Parkinson.
vroege symptomen van Parkinson
Tekenen van progressieve hersenziekte kunnen jaren vóór de belangrijkste symptomen optreden. Dergelijke vroege symptomen van parkinson zijn:
- REM-slaapgedragsstoornis: Normaal gesproken is een persoon in droomslaap “verlamd”. Bij de REM-slaapgedragsstoornis worden de dromerige bewegingen gedeeltelijk uitgevoerd (spreken, lachen, gebaren, enz.). Dit kan gevaarlijk zijn voor de getroffen persoon en de slaappartner.
- Geurgevoel is verminderd of volledig afwezig (hyposmie / anosmie)
- Pijn in spieren en gewrichten (dysesthesie), vaak in het gebied van schouder en arm
- de armen zwaaien minder tijdens het lopen
- Opstaan, wassen, aankleden, eten, etc. duurt langer dan voorheen
- constipatie
- Visuele stoornissen (zoals verstoord kleurenzicht)
- het handschrift lijkt krap en wordt kleiner, vooral aan het einde van een regel of pagina
- depressie
- Vermoeidheid, uitputting
- stijf, onzeker gevoel, beven
- de patiënt trekt zich terug en verwaarloost zijn hobby’s
Veel van deze vroege symptomen van Parkinson zijn niet-specifiek. U kunt dus ook veel andere oorzaken hebben (zoals de gevorderde leeftijd). Daarom worden ze vaak niet herkend als vroege tekenen van Parkinson.
REM-slaap gedragsstoornis
Het belangrijkste vroege teken is de REM-slaapstoornis: degenen die dit type slaapstoornis vertonen, hebben over het algemeen een verhoogd risico op zogenaamde neurodegeneratieve ziekten. Dit zijn progressieve ziekten die gepaard gaan met het verlies van zenuwcellen. De meeste mensen met een REM-slaapstoornis ontwikkelen later de ziekte van Parkinson. Anderen worden ziek met een bepaalde vorm van dementie (Lewy body dementie).
Parkinson: belangrijkste symptomen
De symptomen van de ziekte van Parkinson ontwikkelen zich meestal langzaam. Familieleden en vrienden vangen ze vaak eerder dan de patiënt.
De meeste symptomen van Parkinson beginnen eenzijdig, dat wil zeggen aan slechts één kant van het lichaam. Later verspreidden ze zich naar de andere kant. In de loop van de ziekte worden ze ook meer uitgesproken.
De typische symptomen van Parkinson zijn:
- vertraagde bewegingen (bradykinese) tot lage bewegingen (hypokinese) of immobiliteit (akinesie)
- stijve spieren (rigor)
- Spiertrillingen in rust (trilling van Parkinson)
- gebrek aan stabiliteit van rechtopstaande houding (instabiliteit van de houding)
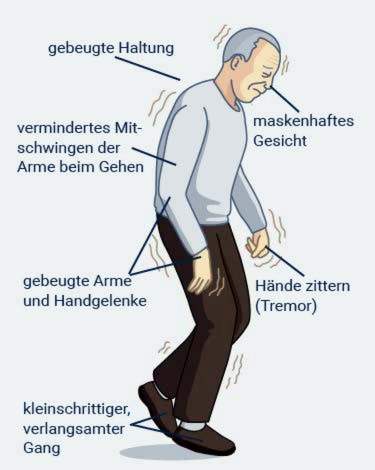
Vertraagde bewegingen (bradykinese): Alle lichaamsbewegingen zijn onnatuurlijk langzaam. Dit betekent bijvoorbeeld dat mensen met de ziekte van Parkinson merkbaar langzaam zijn en in kleine stappen lopen. Na verloop van tijd schuifelt de wandeling en gaan patiënten voorover gebogen. Dat is een van de meest voor de hand liggende symptomen. Patiënten met Parkinson kunnen ook langzaam en moeizaam gaan zitten en weer opstaan. Soms worden de getroffen mensen plotseling geblokkeerd in hun bewegingen – ze lijken te bevriezen. Dit is wat medische professionals “bevriezen” noemen.
De symptomen van de ziekte van Parkinson beïnvloeden ook de gebaren en gezichtsuitdrukkingen: het gezicht gedraagt zich steeds meer als een star masker. De getroffenen spreken meestal stil en monotoon, dus ze zijn moeilijker te begrijpen. Slikken veroorzaakt vaak problemen, zoals drinken of eten. Een ander symptoom van Parkinson is een verstoorde fijne motoriek: de getroffenen hebben bijvoorbeeld moeite om iets te schrijven, hun jas dicht te knopen of hun tanden te poetsen.
Wanneer de lichaamsbewegingen bijzonder langzaam zijn of de patiënt gedeeltelijk volledig bewegingloos is, spreken artsen van akinesie (akinesie).
Stijve spieren:Bij Parkinson zijn er geen verlammingen, maar de spierkracht blijft grotendeels behouden. De spieren zijn permanent gespannen, zelfs in rust. Dit is pijnlijk voor de getroffenen. Vooral het schouder- en nekgebied kan pijn doen.
De spierstijfheid kan worden aangetoond door de zogenaamde Tandradrigiditeit: Wanneer de arts de arm van de patiënt probeert te verplaatsen, wordt dit voorkomen door de stijve spieren. Daarom kan de arm slechts een klein beetje en schokkerig bewegen. Het voelt bijna alsof er een versnelling in het gewricht zit die alleen de beweging naar de volgende inkeping toelaat en vervolgens op zijn plaats klikt. Het versnellingsfenomeen wordt meestal getest in de elleboog of pols. Het is een typische ziekte van Parkinson, maar het kan ook voorkomen bij andere ziekten.
Spiertrillingen in rust (rusttremor): Bij de ziekte van Parkinson beginnen armen en benen in rust te trillen. Daarom wordt de ziekte ook “schuddende parese” genoemd. De ene kant van het lichaam is meestal meer getroffen dan de andere. Bovendien beeft de arm meestal meer dan het been.
De tremor van Parkinson komt kenmerkend voor in rust. Dit kan Parkinson van andere aandoeningen met tremor (tremor) onderscheiden. Als de hand bijvoorbeeld niet in vrede beeft, maar zodra u een gerichte beweging wilt uitvoeren, spreken artsen van de zogenaamde opzettelijke tremor. De oorzaak is een beschadiging of verstoring van het cerebellum.
Overigens hebben de meeste mensen die rillen noch de ziekte van Parkinson, noch enige andere herkenbare neurologische aandoening. De oorzaak van deze “essentiële tremor” is onbekend.
Gebrek aan stabiliteit van rechtopstaande houding: Iedereen corrigeert onbewust zijn houding wanneer hij op elk moment rechtop loopt en staat. Het hele ding wordt bestuurd door zogenaamde controle- en vasthoudreflexen. Reflexen zijn automatische bewegingen die worden veroorzaakt door bepaalde stimuli. Dit zijn onbewuste, onwillekeurige bewegingen of spierspanningen. De vasthoud- en aanpassingsreflexen van de persoon zijn verantwoordelijk voor het feit dat iemand het lichaam automatisch in evenwicht kan houden, zelfs tijdens beweging en niet valt.
Bij de ziekte van Parkinson zijn de setting en hold reflexen meestal verstoord. Getroffen personen worstelen daarom om hun stabiliteit te handhaven. Dit wordt houdingsinstabiliteit genoemd. Het is de reden waarom Parkinson-patiënten niet langer gemakkelijk plotselinge, onvoorziene bewegingen kunnen ‘vangen’, zoals struikelen of een plotselinge windvlaag. Daarom zijn ze onzeker tijdens het lopen en vallen ze gemakkelijk.
Parkinson: bijbehorende symptomen
De symptomen van de belangrijkste Parkinson gaan soms gepaard met andere klachten:
Parkinsonpatiënten hebben er vaker een depressie zo gezond en als mensen met andere chronische ziekten. Soms ontwikkelt de depressie zich alleen in de loop van de ziekte van Parkinson. Bij andere patiënten gaat het vooraf aan de motorische symptomen (beweging vertragen, enz.).
Bovendien, in Parkinsonintellectuele capaciteit verminderen en een zwakzinnigheid ontstaan (zie hieronder). De getroffenen hebben steeds meer moeite met denken. Men moet echter niet vergeten dat zelfs de meest gezonde mensen langzamer kunnen denken en dingen moeilijker kunnen onthouden naarmate ze ouder worden. Dus dat hoeft niet per se een teken van Parkinson te zijn.
Bij veel Parkinson-patiënten produceert de gezichtshuid overtollig talg. Het ziet er vettig en glanzend uit. Artsen spreken van zogenaamde “Zalf face”: Het gezicht van de patiënt ziet eruit alsof de persoon een dikke laag zalf of gezichtscrème heeft aangebracht.
De symptomen van Parkinson omvatten ook blaasaandoeningen: veel patiënten kunnen hun blaas niet goed onder controle houden. Dat kan dus gebeuren onvrijwillig urineren (incontinentie) en de patiënten zelf ’s nachts nat (Enuresis). Maar het tegenovergestelde is ook mogelijk: sommige patiënten hebben problemen met het verlaten van water (urineretentie).
De darm is vaak traag bij Parkinson, dus neem een constipatie ontwikkeld. Een dergelijke constipatie kan ook optreden als een vroeg teken van Parkinson.
Soms komen mannen opdagen potentie problemen (Erectiestoornissen). Deze impotentie kan worden veroorzaakt door zowel de ziekte zelf als de medicijnen van Parkinson.
Alle bijbehorende symptomen kunnen ook worden veroorzaakt door andere ziekten, niet alleen Parkinson.
De ziekte van Parkinson
Parkinson-patiënten zijn gevoeliger voor dementie dan de algemene bevolking: ongeveer een derde van de patiënten ontwikkelt ook dementie tijdens het verloop van de ziekte. Volgens sommige onderzoeken is het risico op dementie van Parkinson zelfs nog hoger (tot 80 procent).
De symptomen van Parkinson-dementie zijn voornamelijk één verstoorde aandacht en een vertraagd denken, Dat is een belangrijk verschil met de ziekte van Alzheimer – de meest voorkomende vorm van dementie. Alzheimerpatiënten lijden voornamelijk aan geheugenstoornissen. Parkinsons dementie komt daarentegen pas in latere stadia van de ziekte voor.
Lees meer in het artikel Dementie in Parkinson.
Parkinson: oorzaken
Artsen diagnosticeren ook de ziekte van Parkinson Primaire of idiopathische ziekte van Parkinson (IPS), “Idiopathisch” betekent dat er geen tastbare oorzaak voor de ziekte kan worden gevonden. Deze “echte” Parkinson vormt ongeveer 75 procent van de syndromen van Parkinson. Hij staat centraal in deze tekst. Om hiervan te onderscheiden zijn de zeldzame genetische vormen van de ziekte van Parkinsondat “secundair Parkinson-syndroom“en dat”Atypisch Parkinson-syndroomZe worden hieronder kort beschreven.
Idiopathische Parkinson: dopamine-tekort
De ziekte van Parkinson wordt veroorzaakt door een specifiek hersengebied, de zogenaamde “zwarte substantie” (substantia nigra) in de middenhersenen. Deze hersenregio bevat veel ijzer en de kleurstof melanine. Beide kleuren de “Substantia nigra” opvallend donker (in vergelijking met het overigens heldere hersenweefsel).
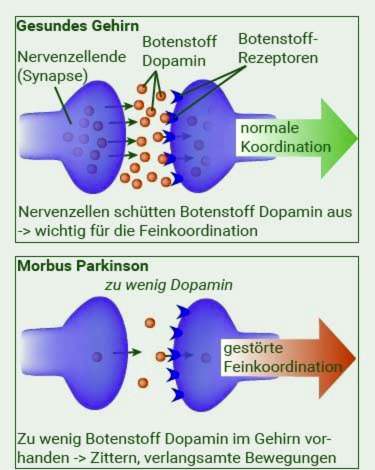
In de “Substantia nigra” bevinden zich speciale zenuwcellen die de neurotransmitter dopamine produceren. Dopamine is erg belangrijk voor het beheersen van bewegingen. In idiopathische Parkinson sterven steeds meer dopamine-producerende neuronen. Waarom weet je niet.
Door deze progressieve celdood blijft het niveau van dopamine in de hersenen dalen – het ontwikkelt zich dopamine-deficiëntie, Het lichaam kan het lange tijd in evenwicht houden: alleen wanneer ongeveer 60 procent van de dopamine-producerende zenuwcellen is overleden, is het dopamine-tekort merkbaar: de patiënt beweegt langzamer (bradykinese) of soms niet langer (akinesie).
Maar het dopamine-tekort zelf is niet de enige oorzaak van de ziekte van Parkinson: het brengt ook de gevoelige Evenwicht van neurotransmitters uit balans: Omdat er steeds minder dopamine aanwezig is, neemt de hoeveelheid messenger acetylcholine relatief toe. Experts suggereren dat dit de oorzaak is van tremor en rigiditeit bij de ziekte van Parkinson.
De onbalans van neurotransmitters in Parkinson kan ook verantwoordelijk zijn voor het feit dat veel patiënten extra depressief worden. Omdat men weet dat in het algemeen bij depressie het evenwicht van de neurotransmitters verstoord is. Het verband tussen de ziekte van Parkinson en depressie is nog niet definitief opgelost.
Oorzaken van Parkinson: veel veronderstellingen, weinig bewijs
Waarom bij de ziekte van Parkinson zenuwcellen in de “substantia nigra” sterven, is nog onduidelijk. Onderzoek suggereert dat verschillende factoren een rol spelen bij de ontwikkeling van de ziekte van Parkinson.
Wetenschappers hebben bijvoorbeeld ontdekt dat zenuwcellen bij patiënten met Parkinson alleen schadelijke stoffen adequaat kunnen verwijderen. Celbeschadigende stoffen zijn bijvoorbeeld de zogenaamde “vrije radicalen”. Dit zijn agressieve zuurstofverbindingen die in verschillende metabole processen in de cel ontstaan.
Zenuwcellen van Parkinson kunnen deze gevaarlijke stoffen mogelijk niet afbreken voordat ze schade veroorzaken. Of het ontgiftingsvermogen van de cellen is normaal, maar het produceert een overmatige hoeveelheid “vrije radicalen” in Parkinson. In beide gevallen kunnen de celbeschadigende stoffen in zenuwcellen zich ophopen en doden.
Er zijn andere mogelijke oorzaken van Parkinson die momenteel worden besproken en onderzocht.
Genetische vormen van Parkinson
Als een familielid lijdt aan de ziekte van Parkinson, maakt dit veel familieleden van streek. Je vraagt je af of Parkinson erfelijk is. In de overgrote meerderheid van de gevallen is Parkinson echter de hierboven beschreven idiopathische ziekte van Parkinson. Overerving is geen probleem in deze sporadische ziektevorm, geloven experts.
Dit is anders in de zogenaamde monogenetische vormen van Parkinson: elk van hen wordt veroorzaakt door de mutatie in een bepaald gen. Deze genmutaties kunnen worden doorgegeven aan de nakomelingen. Monogene vormen van Parkinson zijn erfelijk. Ze worden ook vaak genoemd familiaal Parkinson-syndroom genoemd. Gelukkig zijn ze zeldzaam.
Secundair Parkinson-syndroom
In tegenstelling tot idiopathische Parkinson heeft symptomatisch (of secundair) Parkinson-syndroom duidelijk identificeerbare oorzaken. Deze omvatten:
- Geneesmiddelen: dopamine-remmers (dopamine-antagonisten) zoals neuroleptica (voor de behandeling van psychose) of metoclopramide (voor misselijkheid en braken), lithium (voor depressie), valproïnezuur (voor aanvallen), calciumantagonisten (voor hoge bloeddruk)
- andere ziekten zoals hersentumoren, hersenontsteking (bijv. door AIDS), hypofunctie van de bijschildklieren (hypoparathyreoïdie) of de ziekte van Wilson (koperopslagziekte)
- Vergiftiging met mangaan of koolmonoxide
- Verwondingen van de hersenen
Atypisch Parkinson-syndroom
Atypisch Parkinson-syndroom ontwikkelt zich als onderdeel van verschillende neurodegeneratieve ziekten. Dit zijn ziekten waarbij neuronen geleidelijk afsterven in de hersenen. In tegenstelling tot het idiopathische syndroom van Parkinson beïnvloedt deze celdood niet alleen de “substantia nigra”, maar ook andere hersengebieden. Daarom heeft het atypische syndroom van Parkinson naast Parkinson-achtige symptomen nog meer symptomen.
Neurodegeneratieve ziekten die het atypische syndroom van Parkinson kunnen veroorzaken, zijn onder meer:
- Lewy body dementie
- Multisysteematrofie (MSA)
- Progressieve supranucleaire parese (PSP)
- Corticobasale degeneratie
Dergelijke ziekten hebben een aanzienlijk slechtere prognose dan het “echte” (idiopathische) Parkinson-syndroom.
Overigens helpt het medicijn “L-Dopa”, dat zeer goed werkt bij idiopathische Parkinson, nauwelijks of helemaal niet bij atypische Parkinson.
Parkinson: behandeling
De therapie van Parkinson is individueel aangepast aan elke patiënt. Omdat de ziektesymptomen van persoon tot persoon kunnen variëren en met verschillende snelheden kunnen vorderen.
Meestal is Parkinson bij drugs soms milde symptomen vereisen soms eerst geen therapie. Welke actieve ingrediënten worden gebruikt, hangt voornamelijk af van de leeftijd van de patiënt. Soms kan een neurochirurgische procedure nuttig zijn – de zogenaamde Diepe hersenstimulatie (Deep Brain Stimulation, DBS).
Naast medische en mogelijk chirurgische maatregelen, kan de individuele behandeling van Parkinson andere bouwstenen bevatten. Deze omvatten bijvoorbeeld fysiotherapie, logopedie en ergotherapie, Het is in elk geval logisch om in een speciale Parkinson-kliniek te worden behandeld.
Parkinson-therapie: medicatie
Er zijn verschillende medicijnen voor de therapie van Parkinson. Ze helpen tegen kwalen zoals langzame bewegingen, stijve spieren en tremoren. Ze kunnen echter niet de dood van de zenuwcellen en dus de progressie van de ziekte voorkomen.
De typische symptomen van Parkinson worden veroorzaakt door een tekort aan dopamine in de hersenen. Ze kunnen dus worden verlicht door de boodschappersubstantie als medicijn te leveren (bijvoorbeeld in de vorm van L-Dopa) of door de afbraak van de bestaande dopamine (MAO-B-remmer, COMT-remmer) te stoppen. Beide mechanismen compenseren dopamine-tekort. Ze elimineren grotendeels de typische symptomen van Parkinson.
L-dopa (levodopa)
Patiënten van Parkinson om de ontbrekende dopamine rechtstreeks als een spuit of tablet toe te dienen, hebben geen zin: de boodschapper wordt inderdaad door de bloedbaan naar de hersenen getransporteerd. Maar hij kan de beschermende bloed-hersenbarrière niet overwinnen, dus ga niet direct in het zenuwweefsel. de Voorloper van dopamine maar kan: Deze L-Dopa (levodopa) is daarom geschikt voor de behandeling van Parkinson. Wanneer het de hersenen bereikt, wordt het omgezet in dopamine door het enzym Dopa decarboxylase. Dit kan dan zijn effect in de hersenen ontwikkelen en de symptomen van Parkinson zoals spierstijfheid (rigor) verlichten.
L-Dopa is zeer effectiefen heeftnauwelijks bijwerkingen, Het wordt meestal ingenomen in de vorm van tabletten, capsules of druppels. Artsen schrijven het vooral voor bij patiënten ouder dan 70 jaar. Bij jongere patiënten wordt L-dopa echter slechts zeer ingetogen gebruikt. De reden is dat de behandeling met L-dopa na een paar jaar bewegingsstoornissen (dyskinesieën) en effectfluctuaties (effectfluctuaties) kan activeren (zie bijwerkingen).
L-dopa wordt altijd gecombineerd met een ander actief ingrediënt, een zogenaamd dopa decarboxylase (zoals benserazide of carbidopa). Dit voorkomt dat L-dopa wordt omgezet in dopamine in het bloed, zelfs voordat het de hersenen bereikt. De dopa-decarboxylaseremmer kan zelfs de bloed-hersenbarrière niet overschrijden. In de hersenen kan L-Dopa daarom gemakkelijk worden omgezet in dopamine.
Elke patiënt van Parkinson reageert anders op L-Dopa. Daarom wordt de dosering individueel bepaald: de therapie wordt gestart met een lage dosis en vervolgens geleidelijk verhoogd totdat het gewenste effect optreedt.
Meestal moet L-dopa meerdere keren per dag worden ingenomen. Dit moet altijd op dezelfde tijden zijn. Dit voorkomt een fluctuerend effect.
Het is ook belangrijk dat L-dopa ten minste één uur vóór of na een eiwitrijke maaltijd wordt ingenomen. Eiwitrijk voedsel verstoort de opname van het actieve ingrediënt in het bloed.
Bijwerkingen:De therapie van Parkinson met L-dopa wordt over het algemeen zeer goed verdragen, vooral bij lage doses. Vooral aan het begin van de therapie misselijkheid optreden. Dit kan goed zijn, maar met het actieve ingrediënt domperidon verlichten. Anderzijds mogen andere geneesmiddelen tegen misselijkheid zoals metoclopramide niet worden gebruikt: ze passeren ook de bloed-hersenbarrière en kunnen de effecten van L-dopa neutraliseren.
Andere mogelijke bijwerkingen van L-Dopa zijn anorexia, duizeligheid, verhoogde driveen depressie, Vooral ouderen reageren soms op een behandeling met L-dopa hallucinaties, verwarring en dwangmatig gedrag.Dit laatste manifesteert zich bijvoorbeeld als een gok- of koopverslaving, als een constante drang naar eten of seks of als een dwangmatige ordening van objecten.
ook bewegingsstoornissen (Dyskinesieën) zijn mogelijke bijwerkingen van L-dopa: de getroffen patiënten onwillekeurig trillen of doen schokkerige bewegingenze kunnen niet voorkomen. Hoe langer een persoon met L-Dopa wordt behandeld, hoe frequenter en ernstiger dergelijke bewegingsstoornissen worden.
Langdurige behandeling met L-dopa kan ook het effect van het medicijn doen fluctueren (effect schommelingen): Soms kunnen Parkinson-patiënten helemaal niet bewegen (“OFF-fase”), en daarna weer volledig normaal (“ON-fase”).
In dergelijke gevallen kan dit helpen Verander het doseringsschema van L-Dopa, Of anders gaat de patiënt verder achterlijk L-dopa-preparaat um: de tabletten met vertraagde afgifte geven het actieve ingrediënt langzamer en gedurende een langere periode af dan “normale” (niet-vertraagde) L-dopa-preparaten. De behandeling werkt dan meestal gelijkmatiger.
In geval van fluctuaties in L-Dopa (ON-OFF fasen) en / of bewegingsstoornissen, kan de arts de patiënt ook een draagbare drug pompGeven: het stuurt de levodopa automatisch via een dunne sonde rechtstreeks in de twaalfvingerige darm, waar het wordt geabsorbeerd in het bloed (duodenale sonde). De werkzame stof wordt aldus continu aan de patiënt toegediend. Dit maakt het mogelijk om zeer uniforme bloedspiegels in het bloed te bereiken. Dit vermindert het risico op schommelingen in activiteit en bewegingsstoornissen. Een duodenale sonde brengt echter ook risico’s met zich mee, bijvoorbeeld voor peritonitis. Daarom wordt het alleen in geselecteerde gevallen en door ervaren artsen gebruikt.
Een alternatief voor pomptherapie is diepe hersenstimulatie (zie hieronder).
dopamine-agonisten
Bij patiënten jonger dan 70 jaar wordt de therapie van Parkinson meestal gestart met zogenaamde dopamine-agonisten. Pas later vindt de omschakeling naar de meer effectieve L-Dopa plaats. Dus vertraagt het optreden van bewegingsstoornissen, omdat deze worden veroorzaakt door langdurig gebruik van L-Dopa.
Dopamine-agonisten zijn chemisch vergelijkbaar met de boodschappersubstantie dopamine. Ze passeren gemakkelijk de bloed-hersenbarrière en meren aan op dezelfde bindingsplaatsen (receptoren) van zenuwcellen als dopamine. Daarom hebben ze ook een soortgelijk effect.
De meeste dopamine-agonisten die bij de therapie van Parkinson worden gebruikt, worden oraal ingenomen (bijvoorbeeld als tablet). Dit geldt bijvoorbeeld voor pramipexol, piribedil en ropinirol. Andere middelen worden toegediend als een actieve ingrediëntpleister (rotigotine) of als een spuit of infusie (apomorfine).
Bijwerkingen: Dopamine-agonisten worden minder goed verdragen dan L-dopa. Ze veroorzaken bijvoorbeeld waterretentie in het weefsel (zwelling), constipatie, slaperigheid, duizeligheiden misselijkheid, Net als L-Dopa kunnen dopamine-agonisten ook bij ouderen worden gebruikt hallucinaties, verwarring en dwangmatig gedrag trigger.
Bij langdurig gebruik kunnen dopamine-agonisten ook effectvariaties (Schommelingen met AAN-UIT fasen) trigger. Maar dat gebeurt veel minder vaak dan bij L-Dopa. Het fluctuerende effect kan worden gecompenseerd door de dosering van de dopamine-agonisten wordt aangepast of de patiënt van de tabletten op een medicijnpleister (met rotigotine).
Er is nog een mogelijkheid voor effectschommelingen: de patiënt ontvangt naast de tabletten Spuiten met apomorfine in het onderhuidse vetweefsel (subcutaan). Apomorfine kan het ongemak van Parkinson snel verlichten, wat ondanks tabletinname vervelend is. Mogelijke bijwerkingen zijn misselijkheid, braken, verhoogde of nieuw optredende bewegingsstoornissen (dyskinesie), duizeligheid, hallucinaties enz.
Als al deze pogingen de optredende schommelingen niet kunnen compenseren, ontvangt de patiënt mogelijk een draagbare medicatiepomp (apomorfinepomp). Via een dunne buis en een fijne naald levert het de werkzame stof continu af aan het onderhuidse vetweefsel op de buik of dij (meestal meer dan 12 tot 18 uur).
Tot nu toe ontbreken nog uitgebreide onderzoeken naar deze apomorfinepomptherapie. Studies tonen aan dat ze de dagelijkse UIT-fasen (waarin de patiënt nauwelijks kan bewegen) aanzienlijk kunnen verkorten. Bewegingsstoornissen (dyskinesieën) kunnen ook afnemen met de apomorfinepomp.
Mogelijke bijwerkingen zijn voornamelijk huidreacties op de injectieplaats van de naald, die soms ernstig kunnen zijn (pijnlijke roodheid, Kötchenbildung, weefselsterfte = necrose, enz.). Sommige patiënten klagen ook over misselijkheid, braken, problemen met de bloedsomloop en hallucinaties.
MAO-B remmers
MAO-B-remmers (zoals selegiline) remmen het enzym monoamine-oxidase B (MAO-B), dat normaal dopamine afbreekt. Op deze manier kan het niveau van dopamine in de hersenen van Parkinson-patiënten worden verhoogd.
MAO-B-remmers zijn minder effectief dan levodopa of dopamine-agonisten. Als enige therapie van Parkinson zijn ze daarom alleen geschikt voor milde symptomen (meestal in de vroege stadia van de ziekte). Maar ze kunnen worden gecombineerd met andere Parkinson-medicijnen (zoals L-Dopa).
Bijwerkingen: MAO-remmers worden als goed verdragen beschouwd. Ze hebben alleen milde en omkeerbare bijwerkingen. Deze omvatten slaapstoornissen, omdat de medicijnen de drive verhogen. Daarom moet u MAO-B-remmers eerder op de dag innemen. Dan wordt de slaap ’s avonds niet gestoord.
COMT-remmers
COMT-remmers (zoals entacapon) worden samen met L-dopa voorgeschreven. Ook blokkeren ze een enzym dat dopamine afbreekt (het zogenaamde catechol O-methyl transferase = COMT). Op deze manier verlengen COMT-remmers de effecten van dopamine.
De actieve ingrediënten worden voornamelijk voorgeschreven om effectschommelingen (fluctuaties) tijdens de behandeling met L-dopa te verminderen. Het zijn dus medicijnen voor gevorderde stadia van Parkinson.
Bijwerkingen: COMT-remmers worden meestal goed verdragen. Mogelijke ongewenste effecten zijn diarree, misselijkheid en braken.
anticholinergica
De zogenaamde anticholinergica waren de eerste medicijnen die werden gebruikt voor de therapie van Parkinson. Tegenwoordig worden ze niet zo vaak voorgeschreven.
Vanwege het dopamine-tekort in Parkinson andere boodschappersubstanties – in relatieve termen – in overmaat. Dit geldt bijvoorbeeld voor acetylcholine. Dit veroorzaakt onder andere de typische tremor (tremor) bij de patiënten. Het kan worden verlicht met anticholinergica omdat ze de werking van acetylcholine in de hersenen remmen.
Bijwerkingen: Anticholinergica kunnen verschillende bijwerkingen hebben. Deze omvatten bijvoorbeeld een droge mond, droge ogen, verminderd (zelden verergerd) zweten, aandoeningen van de blaaslediging, constipatie, hartkloppingen, lichtgevoelige ogen, gedachtestoornissen en verwarring.
Vooral oudere mensen verdragen anticholinergica vaak niet zo goed. Daarom worden de medicijnen aan jongere patiënten voorgeschreven.
NMDA-antagonisten
Net als acetylcholine is het boodschapperglutamaat in Parkinson in een relatieve overmaat aanwezig als gevolg van dopamine-tekort. Daarentegen helpen zogenaamde NMDA-antagonisten (amantadine, budipin). Ze blokkeren bepaalde docking-locaties van glutamaat in de hersenen en verminderen dus het effect.
NMDA-antagonisten worden gebruikt in de vroege stadia van de ziekte van primaire Parkinson.
Bijwerkingen:Mogelijke ongewenste effecten van amantadine zijn onder meer rusteloosheid, misselijkheid, verlies van eetlust, droge mond, blauwachtige retinale veranderingen (liveso reticularis) en verwarring en psychose (vooral bij ouderen). Budipin kan gevaarlijke hartritmestoornissen veroorzaken.
Deep Brain Stimulation (DBS)
Diepe hersenstimulatie (THS) is een chirurgische procedure in de hersenen. Het wordt soms uitgevoerd bij het idiopathische Parkinson-syndroom. De Engelse naam is “Deep Brain Stimulation” (DBS).
Bij diepe hersenstimulatie worden kleine elektroden ingebracht in bepaalde delen van de hersenen tijdens een operatie. Ze zijn bedoeld om de pathogene activiteit van de zenuwcellen positief te beïnvloeden (te stimuleren of te remmen). Diepe hersenstimulatie werkt dus net als een pacemaker. Het wordt soms “Brain pacemaker“(Zelfs als deze term niet helemaal correct is).
Diepe hersenstimulatie komt in aanmerking wanneer:
- kan schommelingen in activiteit (schommelingen) en onwillekeurige bewegingen (dyskinesie) met medicatie niet verminderen
- de tremor (tremor) kan niet worden verwijderd door medicatie.
Bovendien moet de patiënt aan nog meer eisen voldoen. Hij vertoont bijvoorbeeld mogelijk geen vroege symptomen van dementie. Zijn algemene fysieke conditie moet goed zijn. Bovendien moeten de parkinson-symptomen (behalve de tremor) op L-dopa reageren.
De ervaring heeft geleerd dat de procedure de symptomen van veel patiënten effectief kan verlichten en hun kwaliteit van leven aanzienlijk kan verbeteren. Het effect lijkt langdurig te zijn. Dat betekent echter niet dat diepe hersenstimulatie Parkinson kan genezen – de ziekte vordert zelfs na de procedure.
By the way: Oorspronkelijk werd diepe hersenstimulatie uitgevoerd, vooral bij geavanceerde Parkinson. Studies hebben echter aangetoond dat het ook zeer geschikt is voor patiënten jonger dan 60 jaar, voor wie L-Dopa-therapie pas recent schommelingen in activiteit heeft aangetoond en bewegingsstoornissen veroorzaakt.
Hoe werkt de procedure?
Diepe hersenstimulatie wordt uitgevoerd in gespecialiseerde klinieken (THS-centra). Voor de operatie wordt een stevig metalen frame stevig aan het hoofd van de patiënt bevestigd. Tijdens de eigenlijke werking is het frame stevig verbonden met de operatietafel. Dit houdt het hoofd altijd exact in dezelfde positie. Dit is nodig om zo nauwkeurig mogelijk met de medische instrumenten te kunnen werken (“stereotactische hersenoperatie”).
Nu wordt een computertomografie (CT) of magnetic resonance imaging (MRI) van de geklemde in de framekop gemaakt. Mit dem Computer lässt sich genau errechnen, in welchem Winkel und in welcher Tiefe im Gehirn die Elektroden eingesetzt werden müssen, damit dann die Elektrodenspitzen am richtigen Ort liegen. Der “richtige Ort” ist in der Regel ein winziges Areal im Gehirn, der sogenannte Nucleus subthalamicus (NST).
Als Nächstes folgt die eigentliche Operation: Der Neurochirurg bohrt mit einem speziellen Bohrer zwei kleine Löcher in die Schädeldecke, um darüber die winzigen Elektroden einzuführen. Das klingt brachial, ist aber für den Patienten nicht mit Schmerzen verbunden. Er ist während der gesamten Operation wach. Das ist nötig, damit der Chirurg die richtige Platzierung der Elektroden in einem Test überprüfen kann.
Am nächsten Tag wird unter Vollnarkose der Impulsgeber unter die Haut am Schlüsselbein oder am Oberbauch implantiert. Über kleine Kabel wird er mit den Elektroden im Gehirn verbunden. Die Kabel verlaufen unter der Haut.
Der Impulsgeber gibt kontinuierlich Strom an die Elektroden ab. Je nach Stromfrequenz werden dadurch die Areale an den Enden der Elektroden stimuliert oder gehemmt. So lindert sofort die motorischen Hauptsymptome der Parkinson-Erkrankung, also verlangsamte Bewegung, Muskelsteifheit und Zittern. Bei Bedarf lässt sich die Stromfrequenz mit einer Fernbedienung nachjustieren.
Sollte der Eingriff nicht den erwünschten Effekt haben, können die Elektroden wieder entfernt oder der Impulsgeber abgeschaltet werden.
Mögliche Komplikationen und Nebenwirkungen
Generell gilt: Die Tiefe Hirnstimulation scheint bei Patienten vor dem 50. Lebensjahr erfolgreicher zu sein und seltener Komplikationen zu verursachen als bei älteren Menschen.
Die wichtigste Komplikation, die sich durch die Hirnoperation selbst ergeben kann, sind Blutungen im Schädel (intrakranielle Blutungen). Außerdem kann das Einsetzen des Impulsgebers und der Kabel eine infectie trigger. Dann muss meist das System vorübergehend herausgenommen und der Patient mit Antibiotika behandelt werden.
Bei fast jedem Patienten kommt es nach dem Eingriff, wenn das System noch eingestellt wird, zu vorübergehenden Nebenwirkungen. Dat kan bijvoorbeeld paresthesie (Parästhesien) sein. Diese treten aber oft nur direkt nach dem Einschalten des Impulsgebers auf und verschwinden dann wieder.
Weitere meist vorübergehende Effekte sind zum Beispiel Verwirrtheit, gesteigerter Antrieb, abgeflachte Stimmungen apathie (Apathie). Manchmal treten auch sogenannte Impulskontrollstörungen op. Dazu zählt zum Beispiel ein gesteigertes sexuelles Verlangen (Hypersexualität). Bei einigen Patienten löst die Tiefe Hirnstimulation auch leichte spraakstoornisseneen Störung der Bewegungskoordination (Ataxie), duizeligheid evenals Gang- und Standunsicherheitout.
Weitere Therapiemethoden
Verschiedene Behandlungskonzepte können Parkinson-Patienten zusätzlich helfen, dass sie möglichst lange ihre Beweglichkeit, Sprechfähigkeit und Selbstständigkeit im Alltag bewahren. Die wichtigsten Verfahren sind:
Physiotherapie: Die Physiotherapie umfasst viele verschiedene Techniken. Die Patienten können zum Beispiel mit geeigneten Übungen ihr Gleichgewicht und ihre Sicherheit beim Gehen trainieren. Sinnvoll sind auch Kraft- und Dehnungsübungen. Die Schnelligkeit und der Rhythmus der Bewegungen lassen sich ebenfalls gezielt trainieren.
Logopädie: Viele Patienten entwickeln im Laufe der Parkinsonerkrankung eine Sprechstörung. Sie sprechen zum Beispiel auffallend monoton und sehr leise oder erleben wiederholt Blockaden beim Sprechen. Eine logopädische Therapie kann hier helfen.
Ergotherapie:Die Ergotherapie hat zum Ziel, dass die Parkinsonpatienten in ihrer persönlichen Umwelt möglichst lange selbstständig bleiben. Dafür passt man zum Beispiel den Wohnraum so an, dass der Patient sich besser zurechtfindet. Außerdem werden Stolperfallen wie Teppiche entfernt. Der Ergotherapeut entwickelt zusammen mit den Betroffenen auch Strategien, wie sich der Alltag mit der Erkrankung besser bewältigen lässt. So zeigt er den Patienten zum Beispiel den Umgang mit Hilfsmitteln wie Strumpfanzieher oder Knöpfhilfe. Zusätzlich berät der Therapeut die Angehörigen, wie sie den Parkinson-Patienten im Alltag sinnvoll unterstützen können.
Behandlung von Begleiterkrankungen
Das Parkinson-Syndrom betrifft oft ältere Menschen. Diese leiden meist zusätzlich noch an anderen Erkrankungen wie Bluthochdruck, Herzschwäche (Herzinsuffizienz), erhöhten Blutfettwerten oder Diabetes. Diese Begleiterkrankungen müssen ebenfalls fachgerecht behandelt werden. Das wirkt sich positiv auf die Lebensqualität und Lebenserwartung der Patienten aus.
Parkinson-Therapie: Was können Sie selbst tun?
Wie bei den meisten chronischen Beschwerden und Erkrankungen gilt auch für Parkinson: Betroffene sollten sich aktiv mit ihrer Erkrankung auseinandersetzen und sich über Ursachen und Behandlungsmöglichkeiten informieren. Denn in vielen Fällen ist es die Angst vor dem Ungewissen, welche die Patienten besonders belastet. Je mehr man über die Erkrankung erfährt, desto eher verschwindet das Gefühl der Machtlosigkeit gegenüber dem fortschreitenden Parkinson.
Heilbar ist die Erkrankung derzeit leider nicht. Mit der richtigen Behandlung ist für viele Patienten aber ein weitgehend normales Leben möglich.
Was Sie selbst zu einer wirksamen Therapie beitragen können, lesen Sie hier:
» Gehen Sie offen mit Ihrer Erkrankung um. Vielen Menschen mit Parkinson fällt es zunächst sehr schwer, die Erkrankung zu akzeptieren und offen damit umzugehen. Stattdessen versuchen sie, die Symptome zu verstecken. So setzt man sich selbst aber unter unnötigen Druck. Wenn Sie offen mit Freunden, Angehörigen und Arbeitskollegen über Ihre Erkrankung sprechen, wird Ihnen das eine gewaltige Last von den Schultern nehmen.
» Informieren Sie sich über die Krankheit. Je mehr Sie über Parkinson wissen, desto weniger unheimlich erscheint er Ihnen vielleicht. Auch als Angehöriger eines Parkinson-Patienten sollten sie sich über die Erkrankung informieren. So können Sie Ihren Angehörigen wirksam und sinnvoll unterstützen.
» Schließen Sie sich einer Parkinson-Selbsthilfegruppe an. Wer sich regelmäßig mit anderen Betroffenen austauschen kann, kommt oft besser mit der Erkrankung zurecht.
» Bleiben Sie fit. Sie können einen guten Allgemeinzustand bewahren, werden Sie körperlich aktiv bleiben. Dazu genügen schon regelmäßige Bewegung (wie Spaziergänge) und leichter Ausdauersport. Die Angehörigen können den Patienten dabei unterstützen.
» Kleine Hilfen im Alltag. Viele Parkinson-Symptome erschweren des Alltag. Dazu zählt etwa das sogenannte “Einfrieren” (Freezing) – der Betreffende kann sich dabei nicht mehr bewegen. Hier helfen visuelle Reize auf dem Boden, beispielsweise aufgeklebte Fußabdrücke, oder akustische Rhythmusgeber (“Links, zwo, drei, vier”). Wichtig für Mitmenschen: Es macht keinen Sinn, den Patienten zur Eile zu drängen oder zu ziehen. Dies verlängert die “Einfrier”-Episode eher.
» Gesunde Ernährung. Menschen mit Parkinson essen und trinken oft zu wenig, weil sie ungeschickt und langsam sind. Manche möchten auch den anstrengenden Toilettengang möglichst vermeiden. Für einen gesunden Allgemeinzustand ist es aber sehr wichtig, dass man ausreichend Flüssigkeit (etwa zwei Liter am Tag) zu sich nimmt und sich ausgewogen ernährt.
Parkinson: Fachkliniken
Menschen mit dem Parkinson-Syndrom sollten nach Möglichkeit in einer Fachklinik behandelt werden. Ärzte und sonstige Mitarbeiter dort sind auf die Erkrankung spezialisiert.
Mittlerweile gibt es in Deutschland zahlreiche Kliniken, die eine Akutbehandlung und/oder Rehabilitation für Parkinson-Patienten anbieten. Einige davon tragen ein Zertifikat der Deutsche Parkinson Vereinigung (dPV). Es wird an Krankenhäuser und Rehabilitationseinrichtungen verliehen, die spezielle diagnostische und therapeutische Angebote für Menschen mit Parkinson und verwandte Erkrankungen haben. Das Zertifikat der dPV wird den Spezial-Kliniken für drei Jahre verliehen. Auf Wunsch der jeweiligen Einrichtung kann es nach erneuter Prüfung jeweils für weitere drei Jahre verlängert werden.
Eine ausgewählte Liste von Spezialkliniken für Parkinson-Patienten finden Sie im Beitrag Parkinson – Klinik.
Parkinson: Untersuchungen und Diagnose
Wenn Sie den Verdacht einer Parkinson-Erkrankung bei sich selbst oder einem Angehörigen haben, ist der Besuch bei einem fachkundign Arzt ratsam. Der Spezialist für Erkrankungen des Nervensystems ist der Neurologe, Am besten gehen Sie zu einem Neurologen, der auf die Diagnose und Behandlung von Parkinson spezialisiert ist. An manchen neurologischen Kliniken gibt es auch eigene Sprechstunden beziehungsweise Ambulanzen für Parkinson-Patienten.
Arzt-Patient-Gespräch
Beim ersten Besuch wird der Neurologe im Gespräch mit Ihnen beziehungsweise dem betroffenen Angehörigen die Krankengeschichte erheben (anamnese). Für die Parkinson-Diagnose ist dieses Gespräch enorm wichtig: Wenn der Patient seine Beschwerden ausführlich schildert, kann der Arzt einschätzen, ob es sich tatsächlich um Parkinson handeln könnte. Mögliche Fragen des Arztes sind zum Beispiel:
- Seit wann ungefähr besteht das Zittern (Tremor) der Hände/Beine?
- Haben Sie das Gefühl, dass Ihre Muskulatur ständig angespannt ist?
- Haben Sie Schmerzen, etwa im Schulter- oder Nackenbereich?
- Fällt es Ihnen schwer, beim Gehen das Gleichgewicht zu halten?
- Fallen Ihnen feinmotorische Tätigkeiten (zum Beispiel ein Hemd zuknöpfen, Schreiben) zunehmend schwer?
- Haben Sie Probleme beim Schlafen?
- Ist Ihnen aufgefallen, dass sich Ihr Geruchssinn verschlechtert hat?
- Wurde bereits bei Angehörigen eine Parkinson-Erkrankung festgestellt?
- Nehmen Sie Medikamente ein, beispielsweise aufgrund psychischer Probleme? (Antipsychotika, „Dopaminantagonisten“ wie Metoclopramid)
Körperliche und neurologische Untersuchung
Neben dem Anamnesegespräch folgen eine körperliche und eine neurologische Untersuchung. Dabei überprüft der Arzt allgemein die Funktion des Nervensystems: Er testet zum Beispiel die Reflexe des Patienten, die Empfindsamkeit (Sensibilität) der Haut und die Beweglichkeit der Muskeln und Gelenke. Dabei achtet er besonders auf die Hauptsymptome von Parkinson:
Verlangsamte Bewegungen (Bradykinese) sind sehr charakteristisch für Parkinson. Der Arzt erkennt sie, indem er Ihren Gang, Ihre Gestik und Mimik beobachtet. Möglicherweise wird er Sie bitten, einige Meter im Untersuchungsraum entlang zu gehen. Dabei kann er auch beurteilen, ob Sie „wackelig auf den Beinen“ sind (posturale Instabilität).
Um festzustellen, ob Ihre Muskeln auffallend steif sind (Rigor), wird der Arzt prüfen, ob sich Ihre Gelenke flüssig bewegen lassen. Bei Parkinson ist die Muskelspannung stark erhöht, so dass die Muskeln einen Widerstand entgegensetzen, wenn der Arzt versucht, ein Gelenk (wie den Ellenbogen) zu bewegen. Dieses Phänomen wird auch als Zahnradphänomen bezeichnet (siehe oben: “Parkinson: Symptome”).
Ob bei Ihnen ein Zittern in Ruhe (Ruhetremor) vorliegt, bemerkt der Arzt während der körperlichen Untersuchung. Wichtig für die Parkinson-Diagnose ist die Unterscheidung zwischen einem Ruhetremor (wie er bei Parkinson auftritt) und anderen Tremorarten. Dazu zählt zum Beispiel der sogenannte Intentionstremor: Bei einer Schädigung im Kleinhirn beginnt die Hand zu zittern, sobald der Betreffende versucht, eine gezielte Bewegung damit auszuführen. In Ruhe zittert die Hand dagegen nicht.
Parkinson-Test (L-Dopa-Test)
Um die Parkinson-Diagnose zu unterstützen, wird manchmal der sogenannte L-Dopa-Test durchgeführt. Dabei erhalten Patienten einmalig die Dopamin-Vorstufe L-Dopa (Levodopa). Das ist jenes Medikament, das zur Standardtherapie bei Parkinson gehört. Bei manchen Patienten bessern sich die Bewegungsstörungen und die steifen Muskeln schon kurz nach der Einnahme (ungefähr eine halbe Stunde danach). Dann liegt vermutlich ein idiopathisches Parkinson-Syndrom vor (Achtung: Der Ruhe-Tremor lässt sich nicht immer mit Levodopa lindern).
Der L-Dopa-Test ist in der Parkinson-Diagnostik aber nur begrenzt aussagekräftig. Denn manche Menschen haben zwar Parkinson, sprechen aber nicht auf den Test an. Dann fällt das Ergebnis falsch-negativ aus. Umgekehrt kann der L-Dopa-Test auch bei anderen Erkrankungen als Parkinson positiv ausfallen. Das gilt zum Beispiel bei manchen (aber nicht allen) Patienten mit einer sogenannten Multisystematrophie. Bei dieser fortschreitenden Erkrankung sterben Nervenzellen in verschiedenen Hirnregionen ab. Das kann ein atypisches Parkinson-Syndrom auslösen.
Wegen dieser Probleme wird der L-Dopa-Test nicht routinemäßig in der Parkinson-Diagnostik empfohlen. Ein weiterer Grund dafür ist, dass er Nebenwirkungen wie Übelkeit und Erbrechen haben kann. Um diesen vorzubeugen, erhalten Patienten vor dem Test in der Regel das Anti-Brechmittel Domperidon.
Der L-Dopa-Test kann auch helfen, die Therapie bei Parkinson zu planen: Bei nachgewiesenem Parkinson kann mit dem Test geprüft werden, wie gut der Patient auf L-Dopa anspricht. Aber auch hier darf man kein eindeutiges Testergebnis erwarten. Manche Patienten sprechen nicht auf den Test an (negatives Ergebnis), lassen sich später aber trotzdem gut mit L-Dopa behandeln.
By the way: Anstelle des L-Dopa-Tests wird zur Parkinson-Diagnose gelegentlich der Apomorphin-Test gemaakt. Hier wird geprüft, ob sich die Bewegungsstörungen nach einer Apomorphin-Spritze bessern. Wenn ja, spricht dies für ein idiopathisches Parkinon-Syndrom. Es gilt hier aber das Gleiche wie beim L-Dopa-Test: Nicht bei jedem Parkinson-Patient fällt der Test positiv aus. Zudem können Nebenwirkungen wie Übelkeit, Erbrechen oder Schläfrigkeit auftreten.
Beeldvormingsprocedures
Mithilfe der Computertomografie (CT) oder der Kernspintomografie (MRT) lässt sich das Gehirn des Patienten bildlich darstellen. Das kann helfen, andere mögliche Ursachen für die vermuteten Parkinson-Symptome auszuschließen, beispielsweise einen Hirntumor. Die Bildgebung des Gehirns hilft also, ein idiopathisches Parkinson-Syndrom von einem sekundären Parkinson oder anderen neurodegenerativen Erkrankungen (wie atypischer Parkinson) zu unterscheiden.
Eventuell werden dazu auch spezielle Untersuchungen durchgeführt. Dazu gehört beispielsweise die SPECT (Single Photon Emission Computed Tomography), eine nuklearmedizinische Untersuchung: Dem Patienten wird dabei zuerst eine radioaktive Substanz verabreicht. Mit dieser lassen sich jene Nervenenden im Gehirn darstellen, die sich bei Parkinson zurückbilden (DAT-SPECT). Das kann Aufschluss in unklaren Fällen geben.
Wenn die Parkinson-Diagnose unklar ist, ordnet der Arzt manchmal auch eine spezielle Variante der Positronen-Emissions-Tomografie (PET) an: die FDG-PET, Die Abkürzung FDG steht für Fluordesoxyglukose. Das ist ein radioaktiv markierter Einfachzucker. Er wird dem Patienten verabreicht, bevor man das Gehirn bildlich mittels PET darstellt. Diese Untersuchung kann vor allem helfen, ein atypisches Parkinson-Syndrom abzuklären. Allerdings ist die Untersuchung zu diesem Zwecke nicht offiziell zugelassen. Sie wird deshalb nur in begründeten Einzelfällen dazu eingesetzt (“off-label-use”).
Weniger aufwändig und kostengünstiger als diese Spezialuntersuchungen ist die Ultraschalluntersuchung des Gehirns (Transkranielle Sonografie, TCS). Sie hilft, ein idiopathisches Parkinson-Syndrom im Frühstadium zu erkennen und gegen andere Erkrankungen (wie atypische Parkinson-Syndrome) abzugrenzen. Dazu sollte der Arzt mit dieser Untersuchung aber umfassende Erfahrungen besitzen. Anderenfalls kann er das Untersuchungsergebnis vielleicht nicht richtig interpretieren.
Wie wird letztlich die Parkinson-Diagnose gestellt?
Es ist nach wie vor oft schwer, die Diagnose Parkinson zweifelsfrei zu stellen. Ein Grund dafür ist, dass es viele verschiedene Erkrankungen gibt, die ähnliche Symptome wie die Parkinson-Erkrankung auslösen.
Das Arzt-Patient-Gespräch (Anamnesegespräch) und die körperlich-neurologische Untersuchung sind essenziell für die Parkinson-Diagnostik. Die weiteren Untersuchungen dienen in erster Linie dazu, andere Gründe für die Symptome auszuschließen. Nur wenn sich die Beschwerden gut durch Parkinson erklären lassen und keine anderen Ursachen dafür gefunden werden, kann die Parkinson-Diagnose (Idiopathisches Parkinson-Syndrom) gestellt werden.
Sonderfall: Genetisch bedingter Parkinson
Wie im Abschnitt “Ursachen” erwähnt, sind genetisch bedingte Formen von Parkinson sehr selten. Sie lassen sich aber mit einer molekulargenetischen Untersuchung kennisgeving. Eine solche Untersuchung kommt in Betracht, wenn:
- der Patient vor dem 45. Lebensjahr an Parkinson erkrankt oder
- mindestens zwei Verwandte 1. Grades an Parkinson leiden.
In diesen Fällen liegt der Verdacht nahe, dass die Parkinson-Erkrankung durch eine Genmutation verursacht wird.
Gesunde Angehörige eines Patienten mit genetisch bedingtem Parkinson können sich ebenfalls einem Gentest unterziehen. So lässt sich feststellen, ob auch sie die auslösende Genmutation aufweisen. Ein solcher Gentest zur Abschätzung des persönlichen Parkinson-Risikos darf aber erst durchgeführt werden, nachdem der Betreffene von einem Facharzt ausführlich genetisch beraten wurde.
Ziekteverloop en prognose
Das idiopathische Parkinson-Syndrom ist eine fortschreitende Erkrankung, die bislang nicht heilbar ist. Je nach Symptomatik unterscheiden Mediziner vier Verlaufsformen:
- akinetisch-rigider Typ: Es treten vor allem Bewegungslosigkeit und Muskelsteife auf, während Tremor kaum oder gar nicht vorhanden ist.
- Tremordominanz-Typ: Das Hauptsymptom ist das Zittern (Tremor).
- Äquivalenz-Typ: Bewegungslosigkeit, Muskelsteife und Zittern sind ungefähr gleich ausgeprägt.
- monosymptomatischer Ruhe-Tremor: Das Zittern in Ruhe ist das einzige Symptom. Sehr seltene Verlaufsform.
Neben der Verlaufsform spielt das Erkrankungsalter eine wichtige Rolle bei Parkinson: Verlauf und Prognose werden davon beeinflusst, ob die Erkrankung in verhältnismäßig jungem Lebensalter (beispielsweise ab dem 40. Lebensjahr) oder aber im höheren Alter ausbricht.
So passiert es bei jüngeren Patienten viel eher, dass die Parkinson-Medikamente Bewegungsstörungen (Dyskinesien) und Wirkungsschwankungen (Fluktuationen) auslösen. Das trifft besonders beim akinetisch-rigiden Parkinson-Typ zu, für den ein frühes Erkrankungsalter typisch ist. Dafür ist L-Dopa bei diesen Patienten gut wirksam.
Anders beim Tremordominanz-Typ: Die Betroffenen sprechen relativ schlecht auf L-Dopa an. Dafür schreitet bei ihnen der Parkinson langsamer voran als bei den anderen Verlaufsformen. Somit hat der Tremordominaz-Typ die günstigste Prognose.
Parkinson: Lebenserwartung
Mitte der 1970er Jahre wurden moderne Parkinson-Medikamente wie Levodopa entwickelt. Das veränderte die Prognose bei “echtem” (idiopathischem) Parkinson: Lebenserwartung und Lebensqualität der Patienten verbesserten sich dank der neuen Wirkstoffe. Laut Statistik hat ein optimal behandelter Parkinson-Patient heute fast die gleiche Lebenserwartung wie eine gleichaltrige gesunde Person: Wenn heute jemand mit 63 Jahren die Diagnose Parkinson bekommt, kann er schätzungsweise noch mit weiteren 20 Lebensjahren rechnen. Zum Vergleich: Mitte des letzten Jahrhunderts lebten Patienten nach der Diagnose im Schnitt noch etwas mehr als neun Jahre.
Die gestiegene Lebenserwartung beim idiopathischen Parkinson-Syndrom kommt dadurch zustande, dass die modernen Medikamente die wesentlichen Beschwerden der Patienten weitgehend beheben. Früher führten solche Beschwerden oft zu Komplikationen, die dann den Patienten vorzeitig sterben ließen. Ein Beispiel: Parkinson-Patienten, die sich kaum noch bewegen konnten (Akinesie), waren oft bettlägerig. Diese Bettlägerigkeit lässt das Risiko für gefährliche Erkrankungen wie Thrombose oder Lungenentzündung massiv ansteigen.
Die verbesserte Lebenserwartung, wie sie hier beschrieben ist, bezieht sich nur auf das idiopathische Parkinson-Syndrom (= den „klassischen Parkinson“). Atypische Parkinson-Syndrome, bei denen die Betroffenen nicht oder kaum auf eine Behandlung mit L-Dopa ansprechen, schreiten meist rascher voran. Sie haben in der Regel eine deutlich schlechtere Prognose.
Verdere informatie
Boek aanbevelingen:
- Parkinson – das Übungsbuch: Aktiv bleiben mit Bewegungs-Übungen (Elmar Trutt, 2017, TRIAS)
- Parkinson: Ein Ratgeber für Betroffene und Angehörige (Willibald Gerschlager, 2017, Facultas / Maudrich)
richtlijnen:
- S3-Leitlinie “Idiopathisches Parkinson-Syndrom” der Deutschen Gesellschaft für Neurologie (Stand: 2016)
Ondersteuning Groepen:
Deutsche Parkinson Vereinigung e.V.:
https://www.parkinson-vereinigung.de